28/02/2019
Discussão de Artigo Científico – 01/03/2019

DIA: 01/03/2019 (Sexta-feira)
LOCAL: Pedreira de Freitas – Prédio Central – FMRP
HORÁRIO: 11h00
A glicólise não é importante para polarização de M2!
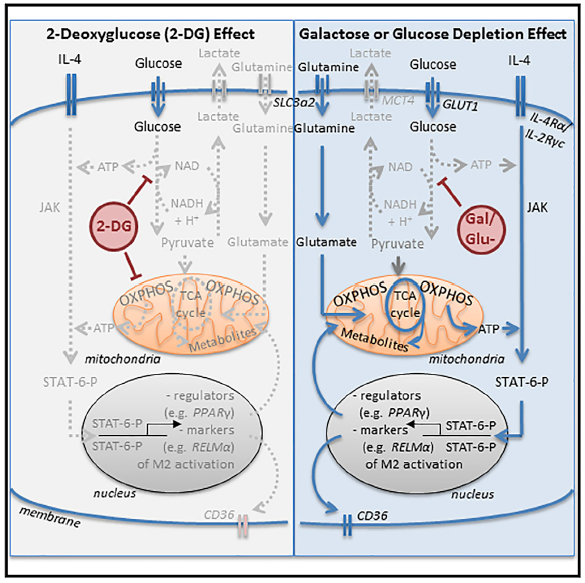
Enquanto que a polarização de macrófagos para o perfil M1, associada a ativação clássica por lipopolissacarídeos (LPS) é impulsionada principalmente pela glicólise, a alternativa ocorre pela interação de interleucina-4 (IL-4) polarizando macrófagos para M2 depende da fosforilação oxidativa (OXPHOS) e da oxidação de ácidos graxos. Esse chamado “interruptor glicolítico” que direciona os macrófagos em direção aos fenótipos M1 ou M2 foi recentemente desafiado por dados que sugerem que a glicólise também pode ser importante para a polarização M2.
No trabalho apresentado, Wang e seus colegas definitivamente abordam este enigma delineando as vias metabólicas complementares que conduzem a polarização do macrófago M2 sob condições distintas. Os autores confirmaram que o análogo da glicose 2-desoxi-D-glicose (2-DG) – conhecido por bloquear a glicólise – inibe a polarização M2 induzida pela IL-4, indicando que esse processo pode estar associado ao desenvolvimento de M2. Embora o tratamento com galactose ou a depleção de glicose no meio de cultura, também inibam a glicólise, a polarização M2 é notavelmente desimpedida nesse cenário.
A grande importância e novidade desse trabalho foi a explicação dessa aparente discrepância. Os autores mostram que a inibição da glicólise via adição de galactose ou depleção de glicose no meio de cultura aumentou os metabólitos do ciclo de Krebs marcados com 13C5-glutamina, indicando que nos macrófagos a glutamina também pode estimular o metabolismo do ciclo de Krebs. Visto que, o tratamento com 2-DG reduziu a função do ciclo de Krebs via inibição do OXPHOS. Além disso, o transdutor Janus quinase / transdutor de sinal e ativador de transcrição (JAK-STAT) 6, normalmente ativado após estimulação por IL-4, que desempenha um papel fundamental na polarização M2.
Nesse trabalho foi demonstrado que apenas a inibição combinada da glicólise e do ciclo de Krebs pelo tratamento com 2-DG inibe a fosforilação de STAT6 induzida por IL-4, porém tanto a inibição não específica da glicólise via tratamento com galactose ou depleção de glicose não foram capazes de reduzir a fosforilação de STAT6. Como o bloqueio da glicólise e do metabolismo do OXPHOS inibe a polarização M2? Dados apresentados pelos autores demonstram que isto pode ser devido à redução acentuada na produção de 5′-trifosfato de adenosina (ATP) causada pela inibição combinada da glicólise e do metabolismo OXPHOS associado ao ciclo de Krebs.
Esses achados delineiam que os macrófagos M2 possuem plasticidade metabólica, permitindo que eles usem glicose (glicólise) ou glutamato (ciclo de Krebs) como fontes de energia para a produção de ATP e manter a polarização M2 sob diferentes condições ambientais. Este trabalho avança nossa compreensão da programação metabólica e plasticidade fenotípica em macrófagos além novas estratégias para a reprogramação metabólica de macrófagos como um meio potencial para tratar doenças inflamatórias associadas a macrófagos.
Outras Notícias
18/06/2025
O Exemplo de Sabin Foi Salvar Vidas
18/06/2025
JUNHO VERMELHO: Mês de campanha da conscientização de doação de sangue
Saiba mais!
18/06/2025
SANA: composto que auxilia na queima de gordura e no controle da obesidade
17/06/2025
FMRP recebe palestra especial sobre moderna tecnologia de proteômica espacial
Saiba mais!
Todas Notícias