07/12/2017
Discussão de Artigo Científico – 11/12/2018

DIA: 11/12/2017 (segunda-feira)
LOCAL: Anfiteatro Pedreira de Freitas – Prédio Central – FMRP
HORÁRIO: 11:00 horas
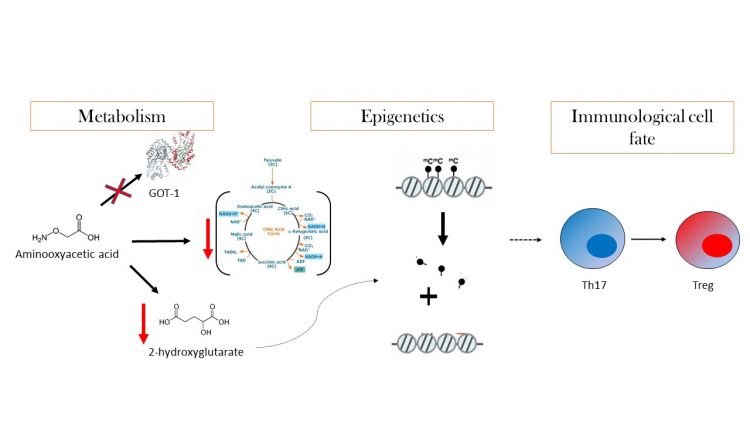
Através da regulação entre as vias bioenergéticas e biosintéticas, o metabolismo ocupa a interface que integra a epigenética e a transcrição de genes para modular o destino (do inglês: ‘cell fate’) e função celulares. Até o momento, já é sabido que o metabolismo tem um papel importante na diferenciação dos linfócitos T reguladores (Treg), porém, se o metabolismo poderia influenciar a diferenciação celular por mecanismos epigenéticos (e de que forma) ainda não estava claro. Desta forma, estudando o efeito de compostos sintéticos no metabolismo de linfócitos, (dentre dez mil compostos testados) descobriu-se que o ácido aminooxidoacético (AOA) é capaz de reprogramar a diferenciação de linfócitos T helper Th17 para Treg porque inibe uma importante enzima transaminase. Em condição de normalidade, durante a diferenciação das células Th17, o aumento da transaminação pela ação da enzima glutamato acetato transaminase 1 (GOT1) leva a um aumento nos níveis do metabólito 2-hidroxiglutarato, cujo acúmulo resulta na hipermetilação no locus do gene Foxp3 e, consequentemente, na inibição da sua transcrição. O composto AOA atua na inibição da conversão do glutamato em α-cetoglutarato, prevenindo a produção de 2-hidroxiglutarato e consequentemente reduzindo a metilação do locus do gene Foxp3 e aumentando a sua transcrição. A consequência direta é o bloqueio da diferenciação de Th17 pelo fato de o Foxp3 antagonizar o fator de transcrição RORγt e promover a diferenciação de iTregs. De fato, a inibição seletiva da enzima GOT1 pelo AOA diminuiu a diferenciação de Th17 e aumentou Treg no modelo terapêutico de encefalomielite autoimune, corroborando com os resultados in vitro. Em resumo, a inibição de uma via metabólica dependente do glutamato pela inibição de uma única enzima (GOT1) representa uma nova estratégia para o desenvolvimento de agentes terapêuticos contra doenças autoimunes mediadas pelas células Th17.
Outras Notícias
02/05/2024
DISCUSSÃO DE ARTIGO CIENTÍFICO - 03/05
Sepsis-trained macrophages promote antitumoral tissue-resident T cells
24/04/2024
Discussão de Artigo Científico - 26/04/2023
Artigo: CD4+ T cell activation distinguishes response to anti-PD-L1+anti-CTLA4 therapy from anti-PD-L1 monotherapy
24/04/2024
Especial Mulheres: Cientistas Notáveis
Confira o 2° e 3° Episódio da série Cientistas Notáveis!
16/04/2024
DISCUSSÃO DE ARTIGO CIENTÍFICO - 19/04
"CGRP sensory neurons promote tissue healing via neutrophils and macrophages"
Todas Notícias